复杂行为神经机制的研究不仅是神经科学领域的重大问题,也有助于启发高适应性的类脑人工智能。理解神经元动态如何产生行为,不仅需要高分辨、大规模的神经记录技术,也要求这些技术能够兼容动物的自然行为。先进的台式显微镜可以实现单细胞分辨率下对多脑区神经群体的活动的观测,但需要将小鼠头部固定在显微镜下,严重限制了小鼠的自然行为。与此相对,近年来发展的微型化显微镜可以被小鼠佩戴在头上跟随小鼠运动,为社交、睡眠、空间认知等复杂行为机制的研究带来了有力工具。然而,由于系统体积的固有限制,现有的头戴式显微镜的性能高度受限,只能实现小视场或低分辨的神经观测,且容易受到轴向系统漂移带来的伪影干扰。如何在严重受限的系统体积内实现高分辨、大视场、大景深的神经成像,是神经科学领域一个亟待解决的重大挑战。
2024年6月20日,清华大学戴琼海院士团队在Nature Biomedical Engineering在线发表了一篇题为A miniaturized mesoscope for the large-scale single-neuron-resolved imaging of neuronal activity in freely behaving mice的工作。针对传统光学设计受系统体积限制的难题,该研究提出一种基于衍射光学元件(DOE) 的系统优化方法,研制了一种新型的系统优化微型显微镜 (SOMM) 。通过联合优化紧凑的衍射光学元件和计算重建算法,SOMM在保持重量和体积限制的同时实现最优的成像性能,可以在直径3.6mm视场范围内,以4微米的分辨率和300微米的景深,实现高达16 Hz的神经元群体活动记录。SOMM在自由活动小鼠的社会互动、条件反射实验、多平面同时观测和神经血管耦合研究中展示了其出色的成像性能,为神经科学研究提供了新的技术平台。

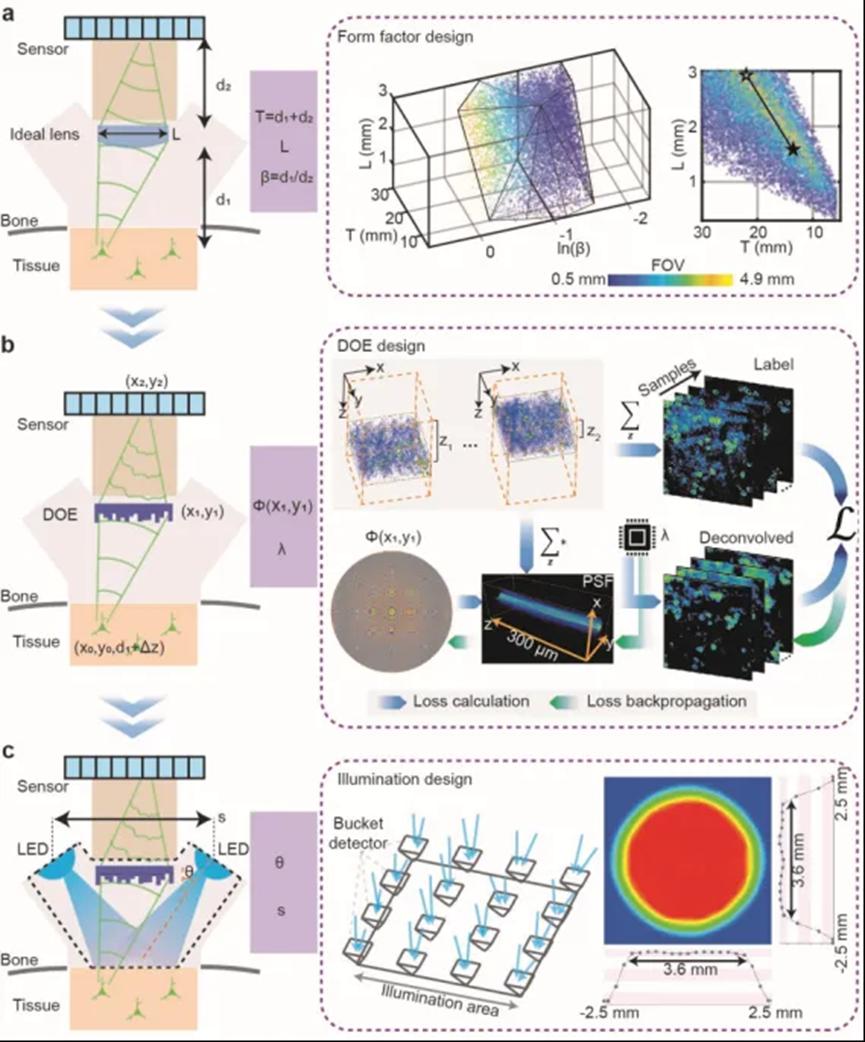
图1 系统优化框架
为了克服现有技术在实现大视场和轻量化神经记录的限制,研究团队开发了一套系统的优化方案。首先,团队基于理想透镜假设,优化镜头样品距离、传感器镜头距离和镜头直径的组合,在保持单细胞分辨率的前提下最小化系统体积、最大化视场范围。根据优化后的透镜参数,团队通过联合优化衍射光学元件和解卷积重建算法来逼近理想透镜成像效果。基于真实的神经数据生成模型和可微分的成像模型,团队针对神经成像任务对衍射光学元件 (DOE) 的相位分布和去卷积算法的参数进行了端到端的优化,以实现在大视场范围内均匀的神经观测性能。此外,团队还优化了DOE的轴向点扩散函数 (PSF) ,使其比衍射极限PSF延长约五倍,从而增强了系统在自由行为成像中的轴向漂移和运动伪影的鲁棒性。
镜头优化完成后,团队对照明配置进行优化,通过优化LED的角度和位置实现视场范围内的均匀照明,并支持双色成像,可以同时记录两个通道的荧光活动。最后,团队对系统结构和线缆连接进行优化,在保证稳定信号的同时,最小化对小鼠运动的影响。优化后的系统仅重2.5g,对小鼠运动几乎没有影响,能够在3.6×3.6 mm²视场内,以4微米的横向分辨率和300微米的景深,进行大规模细胞分辨率的神经元群体记录。实验结果显示,SOMM在视场和景深范围内不同位置的成像性能均保持一致,证明了其设计的优越性。
为实现对神经记录的准确性的定量验证,团队搭建了SOMM-双光子联合成像系统,实现了对同一脑区神经活动的同时记录。通过与金标准双光子成像结果的对比,团队验证了SOMM可以实现精确的神经元定位和神经活动记录,在景深范围内的不同位置都可以实现稳定的神经成像效果,具有高可信性和鲁棒性。
SOMM的设计使其成为在自由活动小鼠中进行大规模神经记录的理想工具。在自由探索、社交互动和恐惧条件反射等实验中,SOMM能够对多个脑区中高达三千多个神经元活动的同时记录。这种大规模记录能力使研究人员能够观察神经元群体在自然行为中的动态变化,揭示不同皮层区域神经活动的时空模式和信息整合机制,从而支持对复杂行为和认知过程的深入研究。
除神经成像外,SOMM还支持在同一实验中同时进行多种成像。通过其双色成像功能,SOMM能够同时记录神经元和血管网络的活动,揭示神经血管耦合在自由行为中的作用。此外,SOMM的大视场使其能够适应不同的成像需求,例如通过柱镜填埋进行焦面映射实现皮层和海马区的同时成像,有助在自由运动条件下研究皮层海马共同空间编码的机制。这些多样化的成像能力使SOMM成为研究神经系统复杂互动的强大工具,有望推动对脑功能的全面理解。