清华大学戴琼海院士团队长期致力于介观活体生物成像领域的研究,在2013年国家自然科学基金委重大仪器项目的支持下,成功研制了国际首台亿像素宽视场介观荧光显微镜(Real-time, Ultra-large-Scale, High-resolution, RUSH1),被誉为介观显微成像领域的先驱。在过去的7年时间里,进一步通过计算成像原理创新,以扫描光场成像原理实现非相干光场的超精细四维感知与重构2,提出了数字自适应光学架构,通过记录高维成像过程与自适应重构,打破传统成像为人眼设计“所见即所得”所引起的固有桎梏,先后突破了光学像差3、三维运动伪影4、背景荧光5、光子噪声6-8、组织散射9等活体成像壁垒,并在同一架构上集成,研制了新一代介观活体显微仪器RUSH3D10,被誉为介观成像的一次飞跃11,入选“两院院士评选2024年中国十大科技进展新闻”。然而,成像性能的快速提升也对大规模数据处理提出了更高的要求12,有监督深度神经网络能够加速三维重建过程,却面临泛化性难题,难以广泛适用于复杂环境下的各类样本。如何能够既“真”又“快”,让仪器使用者能够实时获取高保真的高分辨三维信息,而无需重新训练新的神经网络,仍然是阻碍计算成像显微镜广泛使用的“拦路虎”。
2025年5月12日,清华大学戴琼海、吴嘉敏,天津大学杨敬钰作为共同通讯在Nature Methods上发表文章Physics-driven self-supervised learning for fast high-resolution robust 3D reconstruction of light-field microscopy. ˙该研究针对这一悬而未决的难题,研发了物理驱动的自监督三维重建网络SeReNet,能够以毫秒级实时处理的速度实现高保真高分辨率的光场三维重建,同时无需配对的训练数据。SeReNet通过逐渐缩小网络预测的重投影和原始采集之间的距离,将成像先验完全集成在网络训练中,从而引导网络依据原始采集进行重建推理,而非依据端到端的数据映射过度生成细节。研究团队针对性地考虑了实际活体观测场景中常见的强噪声、样本非刚性运动和光学像差等问题,使得SeReNet仅使用预训练网络就能被广泛应用于常见的所有样本,有效对抗像差、噪声等复杂成像环境干扰。团队在仿真测试和斑马鱼胚胎发育、斑马鱼幼虫免疫反应、阿米巴虫群体交互、线虫神经记录和小鼠肝损伤等多种模式动物实验中,验证了SeReNet高速高保真的三维重建能力,并在国际上首次实现了连续数日时程的超长时程亚细胞分辨率高速三维多色成像与实时三维重建。
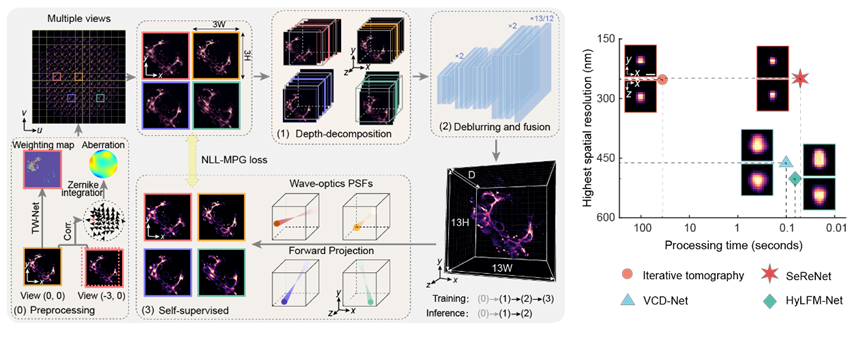
图1 SeReNet
光场显微镜通过光路设计实现多视角图像同时采集,可以简单理解为一种特定的多角度和离焦模糊的叠加,而其重建过程就是输入采集光场图,输出观测场景的三维体表示。受到“重聚焦”的启发,SeReNet首先将多角度特征按视角几何方向进行反投影(深度分解模块)对齐到三维空间,然后经过一个三维卷积神经网络(去模糊和融合模块)做多视角融合到最终的三维重建。在训练时,SeReNet使用物理光学点扩散函数(Point Spread Function, PSF)将网络预测重投影到光场4D空间域,通过缩小重投影光场和输入光场之间的距离实现参数优化更新(自监督模块)。SeReNet的核心设计理念是利用多视角几何光学先验的轻量和高信息密度的特性,来设计网络前向推理保证速度,同时利用PSF物理先验的准确性,来设计反向训练以提升精度,最终实现高速、高分辨的自监督三维重建(对于429×429×101的三维体,每秒20帧左右)。
SeReNet在多种活体生物实验的重建测试
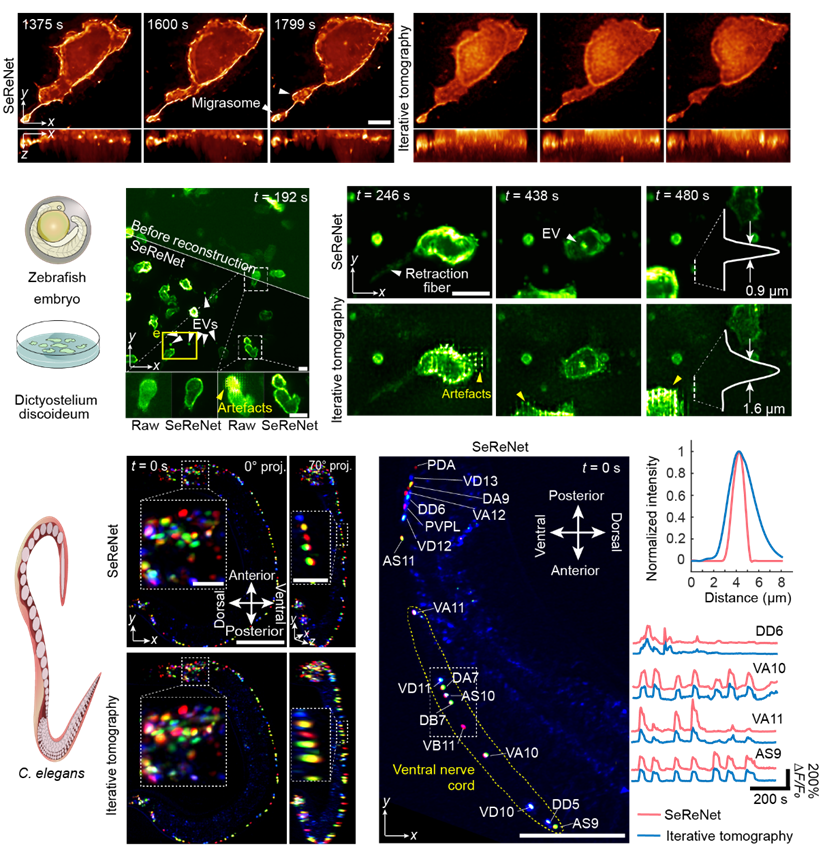
图2 SeReNet在斑马鱼胚胎发育过程中的重现,斑马鱼幼鱼的免疫反应,棘阿米巴虫的群体相互作用,以及秀丽隐杆线虫的神经记录研究
迁移体是21世纪新发现的细胞器,尺寸很小,仅有亚微米级,需要高分辨观测,SeReNet成功记录了斑马鱼胚胎发育过程中两个迁移体的产生过程。此外,阿米巴虫群通过胞外囊泡进行信息交流的行为、完整线虫的长时间自发神经活动等成像实验进一步验证了SeReNet在实际活体观测场景中依旧能实现高速高清三维观测。
活体鼠肝损伤后体内亚细胞行为活动记录

图3 在小鼠肝脏损伤实验中,观察免疫细胞与内皮细胞之间的相互作用
研究团队使用SeReNet观测鼠肝损伤后,体内免疫细胞修复损伤的机制。肝脏缺血再灌注(Liver Ischemia–Reperfusion Injury, LIRI)手术中,相比于对照组,实验组中性粒细胞数量显著增加,并且值得关注的是,SeReNet观测到了一个中性粒细胞被巨噬细胞的收缩纤维牵拉的交互行为。有趣的是,中性粒细胞尾端产生的迁移体也会产生收缩纤维将其输送到巨噬细胞中。另一种肝损伤是药物肝损伤(Acetaminophen-Induced Liver Failure, AILF),在注射对乙酰氨基酚16小时后,SeReNet观测到内皮细胞招募单核细胞并相互粘附的行为。考虑到募集和粘附是细胞间通讯的常见模式,由此判断内皮细胞和免疫细胞之间可能存在信号传导,是加剧哺乳动物肝损伤的潜在诱因之一。因此,靶向CD63+内皮细胞有望为开发药物性肝衰竭的有效疗法提供新的见解。
炎症风暴的48小时连续三维检测
图4 在斑马鱼幼鱼接受尾部分割手术后,对其全身免疫细胞活动进行记录和分析
图5 追踪斑马鱼幼鱼全身免疫细胞的活动:尾部分割手术组与对照组的比较研究
在生物体内,免疫炎症风暴通常持续数天的时间,在这个过程中,免疫细胞非常活跃,依赖于毫秒级精度的动态监测。这种跨4-5数量级的时间尺度会带来数十万帧的数据规模,对成像与重建带来了巨大挑战。而SeReNet正好填补了这一空白。研究团队对斑马鱼幼虫尾部受伤后的免疫反应进行了2天共计48小时的连续拍摄,产生了超过345,600个待重建的数据,传统方法需要两年左右的时间才能看到最终的结果,而SeReNet可以在一周内重建完所有的三维体数据,使得大规模生物实验三维观测和分析成为可能。
基于该系列成果的核心专利已于清华大学转化成立了国产自主先进显微仪器公司(浙江荷湖科技有限公司),致力于国产自主可控具备国际领先性能的高端光学显微镜以及其在生命科学等领域的前沿应用。已支撑清华、北大、北航、北师大、解放军总医院、同济医院等国内高水平科研机构,在肿瘤学、免疫学、脑科学等不同领域开展了20余项创新性生命科学研究,服务于生命科学发现、基础医学和生物制药等领域。
清华大学自动化系博士后卢志,复旦大学未来信息创新学院和上海创智学院联培博士生金满昌是本文的共同第一作者,清华大学自动化系戴琼海院士、吴嘉敏副教授,天津大学通信系杨敬钰教授为本文的共同通讯作者,陈帅、王小鸽、孙飞昊、张琦、赵志锋参与并作出重要贡献。该工作得到了国家自然科学基金、北京市自然科学基金、科技部重点研发计划、清华-福州联合数据技术研究中心、国家博士后创新人才支持计划、中国博士后科学基金、清华水木学者项目、清华大学-北京大学生命科学联合中心的大力支持。
原文链接:https://www.nature.com/articles/s41592-025-02698-z
参考文献
1. Fan, Jingtao, et al. Video-rate imaging of biological dynamics at centimetre scale and micrometre resolution. Nat. Photonics 13, 809–816 (2019).
2. Wu, Jiamin, et al. Iterative tomography with digital adaptive optics permits hour-long intravital observation of 3D subcellular dynamics at millisecond scale. Cell, 184, 3318-3332 (2021).
3. Wu, Jiamin, et al. An integrated imaging sensor for aberration-corrected 3D photography. Nature, 612, 62-71 (2022).
4. Lu, Zhi, et al. Virtual-scanning light-field microscopy for robust snapshot high-resolution volumetric imaging. Nat Methods 20, 735–746 (2023).
5. Lu, Zhi, et al. Long-term intravital subcellular imaging with confocal scanning light-field microscopy. Nat Biotechnol 43, 569–580 (2025).
6. Li, Xinyang, et al. Reinforcing neuron extraction and spike inference in calcium imaging using deep self-supervised denoising. Nat Methods 18, 1395–1400 (2021).
7. Li, Xinyang, et al. Real-time denoising enables high-sensitivity fluorescence time-lapse imaging beyond the shot-noise limit. Nat Biotechnol 41, 282–292 (2023).
8. Zhang, Guoxun, et al. Bio-friendly long-term subcellular dynamic recording by self-supervised image enhancement microscopy. Nat Methods 20, 1957–1970 (2023).
9. Zhao, Zhifeng, et al. Two-photon synthetic aperture microscopy for minimally invasive fast 3D imaging of native subcellular behaviors in deep tissue. Cell 186, 2475-2491, (2023).
10. Zhang, Yuanlong, et al. Long-term mesoscale imaging of 3D intercellular dynamics across a mammalian organ. Cell 187, 6104-6122 (2024).
11. Strack, R. A leap for mesoscale imaging. Nat Methods 21, 1973-1973 (2024).
12. Li, Xinyang, et al. Challenges and opportunities in bioimage analysis. Nat Methods 20, 958–961 (2023).